不少商家为招徕带孩子的顾客在店铺门口摆放了电动摇摇车,但是这些造型可爱、备受幼儿喜爱的摇摇车真的安全卫生吗? 我家楼下的摇摇车,从早唱到晚,吵得让人无法休息。声音很...
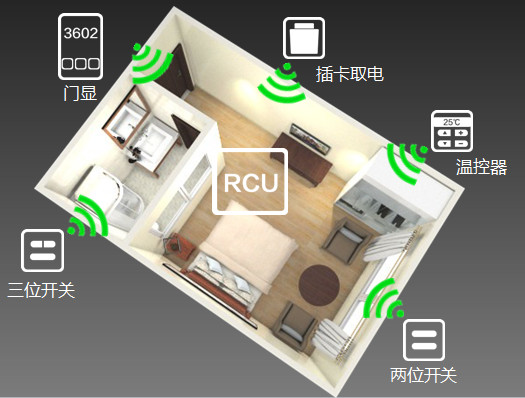
选择酒店客控系统,您是否同样面临以下困扰?
客控系统方案个性化
客控系统方案有没有个性化和差异化,能不能体现出酒店特色?
客控售后服务
客控售后服务怎么样?如果系统出现故障怎么办?
客控系统可靠性
客控系统可靠性怎么样?如果经常坏,客人意见大。智能化的功能,客人会不会用?
维修周期
客控系统维修周期长,售后服务没有保障,影响客房销售?业绩下滑?
emc易倍四大优势 / 专注于客房控制系统研发15年
技术先进
1、采用先进的P-BUS模块化客房控制系统,配置更灵活;性能更可靠,故障率极低;在线调试,远程维护和升级,彻底告别繁琐的现场施工。2、互动式绿色环保模式,让客人主动为您节能省钱。3、开放的软件后台,全自助式系统功能设置。
一站式服务
1、免费技术咨询,7天24小时响应;2、免费方案设计3、项目全程跟踪指导、培训;4、系统软件远程配置、维护和升级;5、售后半年一次免费巡检;6、强大的技术团队,随时应对任何需求。
质量性能可靠
1、先进的贴片工艺,ISO9001质量体系,全程可控2、德国进口拜耳PC材料; 750°高强度钢化玻璃,高硬度、耐划伤、安全性高,外观时尚大气。3、统一采用安全性一流的16A规格。4、面板颜色可定制,满足各种装修风格的客房需要。
个性化方案定制
1、整合了“酒店PMS”、“模块化客房控制系统”2、可对接“智慧电视”、“智能腕表”、“智能门锁”;3、实现“微信自助入住及退房”;4、对连锁酒店,派研发人员和酒店方共同研究,完成个性化的定制方案;5、成熟完善的各种类型酒店案例可供参考。
emc易倍系列 / 智能客控系统引领者
客户眼中的emc易倍 / See What People Say About Us
我接触到普杰客房控制系统,是在北京的一次智能建筑展会上。普杰的展位虽不显眼,但是展出的样品却一下吸引了我。这是一套模块化的酒店客房控制系统,虽然当时还只是样机,但是设计理...
北京清华城市规划设计研究院
合作的过程总体还是比较顺利的,技术方案是按我们的要求设计的。样板房阶段出现了一些小的插曲,包括功能需求上做的一些调整,包括普杰的技术人员和我方施工维护人员的沟通和...
南京状元楼酒店
在考察了普杰工厂以后,我们对于普杰的生产供货能力有了直观的了解,打消了生产供货能力方面的疑虑。普杰全面了解了项目需求后,做了一份完整的针对这个项目的技术方案,并派...